Teori HSAB (hard soft acid and base) yang menggolongkan asam dalam tiga kategori (asam keras, sedang dan asam lunak) dan basa juga dalam tiga kategori (basa keras, sedang dan basa lunak) merupakan pengembangan dari teori asam basa Lewis.
Asam lewis meliputi:
1. H+, karena memiliki orbital kosong 1s
2. senyawa yang kekurangan elektron valensi menurut aturan oktet, seperti BeH2, AlH3, dan BH3
3. Spesies yang memiliki kemampuan untuk menambah elektron valensinya lebih dari 8, seperti PR3, dan SR2
4. Spesies yang memiliki ikatan rangkap polar sehingga memiliki kutub positif sehingga dapat menarik pasangan elektron, seperti R2C=O, O=C=O, dan O=S=O
Sedangkan basa lewis meliputi:
1. Carbanion, R3C:-
2. NH3, PH3, AsH3, SbH3, dan basa konjugasinya dan turunanya (PR3 dll)
3. H2O, H2S, basa konjugasinya dan turunanya.
4. Anion-anion halida
5. Senyawa yang memiliki ikatan rangkat dua dan ikatan rangkap tiga dan ion-ionnya.
Untuk menentukan atau membandingkan kekuatan relatif antar basa lewis dapat dilakukan dengan mengukur perubahan entalpi reaksi dengan menggunakan standar asam. Khusus untuk kekuatan basa dengan standard asam proton (H+), pada asam basa Bronsted-Lowry, dikenal sebagai afinitas proton (PA). Kebasaan diukur dengan afititas proton (kkal/mol) pada keadaan gas sesuai urutan:
CH
3->NH
2->H
->OH
->F
->SiH
3>PH
2>HS
->Cl
->Br
->I
->NH
3>PH
3>H
2S>H
2O>HI>…
Namun jika asam standarnya diganti selain proton, afinitas terhadap asam terukur belum tentu sama dengan urutan tersebut, seperti terjadi pada penggunaan asam lewis Hg
2+.
Hg
2+ : afititas I
- > Br
- > Cl
- >F
-
Sc
2+ : afititas F
-> Cl
-> Br
- >I
-
Kareana keadaan yang demikian kemudian
Ahrland, Chatt dan Davies, membagi table periodik dalam 3 kelas yaitu
Klas a : afinitas terhadap F
- lebih besar daripada afinitas terhadap I
-
Klas b :
borderline /sedang
Klas c : afinitas terhadap I
- lebih besar daripada afinitas terhadap F
-
Penjabaran lebih jauh sifat-sifat keasaman dan kebasaan yang dikembangkan dari pemikiran Ahrland, Chatt dan Davies dikemukakan oleh Pearson (1968) yang menggolongkan akseptor dan donor elektron ke dalam asam dan basa keras dan lunak.
| Asam/basa keras | Asam/basa lunak |
| Ukuran kecil | Ukuran besar |
| Densitas muatan besar | Densitas muatan kecil |
| Polarisabilitas rendah | Polarisabilitas tinggi |
Asam-basa keras digambarkan sebagai suatu spesies yang mempunyai ukuran relatif kecil, bermuatan tinggi dan mempunyai polarisabilitas rendah. Sebaliknya asam-basa lunak digambarkan sebagai suatu spesies yang mempunyai ukuran relatif besar, bermuatan rendah dan mempunyai polarisabilitas tinggi.
Tabel 1. Klasifikasi beberapa asam basa berdasar HSAB (Bowser, 1993 )
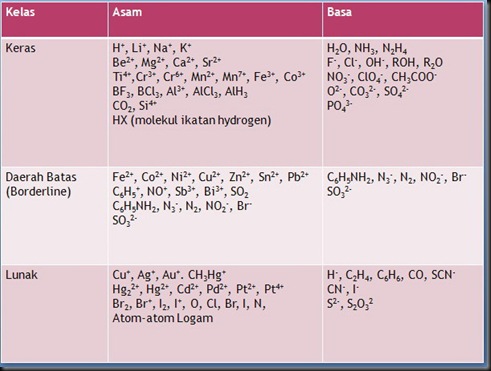
Terdapat hubungan antara energi orbital dengan kekerasan ataupun kelunakan asam-basa. Asam keras lebih stabil kemungkinannya pada orbital LUMO (lowest unoccupied molecular orbital), sedangkan basa keras kurang stabil pada orbital HOMO (highest occupied molecular orbital). Besarnya perbedaan energi antara orbital asam-basa keras menyebabkan transfer muatan dari basa ke asam sangat eksotermik, dalam hal ini interaksi yang paling dominan adalah interaksi ionik. Sebaliknya asam dan basa lunak mempunyai energi orbital molekul yang kira-kira setara, sehingga interaksi kovalen menjadi sangat dominan. Overlab orbital yang paling efektif adalah orbital yang mempunyai level energi yang setara. Umumnya asam keras lebih cenderung untuk berpasangan dengan basa keras, sedangkan asam lunak lebih menyukai basa lunak.
Donor number dan Acceptor number
Donor numbe r(DN) dan acceptor number (AN) khusus dipakai untuk penentuan aspek kuantitatif dari tendensi keasaman Lewis pelarut atau kebasaan Lewis pelarut. Ukuran kuantitatif menggunakan data thermodinamika. Jika Afinitas Proton (PA) diukur dengan menggunakan proton sebagai asam, maka pengukuran DN (pendonoran) dan AN digunakan SbF5 dan SbCl5 sebagai asam. Pengukuran DN menggunakan SbF5. sedangkan pengukuran AN menggunakan SbCl5. SbCl5 memiliki harga AN = 100, dan harga DN= - sedangkan heksana memiliki harga AN = 0. Satuan DN dan AN dalam kkal/mol. Pelarut dengan harga DN lebih besar dari pada AN (misalnya piridin dan dietil eter) memiliki kecenderungan lebih kuat sebagai basa lewis. Sedangkan pelarut dengan harga AN lebih besar dari pada DN (misalnya metanol dan asam asetat) maka pelarut tersebut memiliki kecenderungan lebih kuat sebagai asam lewis.
REFERENSI
Bowser, J.R.,
Inorganic Chemistry, 1993, Brooks/Cole Publishing Company, California.
Sharpe, A. G.,
Inorganic Chemistry, 3th edition, 1992, John Wiley and Sons, Inc., New York.








0 komentar:
Posting Komentar